Ihr bevorzugter Partner im Bereich Medizin-produkte
Beratung
Dienstleistung
Schulung
Wir beraten und unterstützen Sie von der Idee bis zur Zulassung.
Dazu gehört die Erstellung der Technischen Dokumentation und der Aufbau von QM Systemen nach ISO 13485. Wir betreuen und beraten Sie auch im Bereich Post-Market Surveillance, übernehmen die Aufgaben des PRRCs (MDR Art. 15) und bereiten Sie auf Audits vor.
Wir bieten Ihnen alles von einzelnen Beratungsleistungen bis hin zum Rundum-Sorglos-Paket.
Beratungsangebote
Wir bieten Ihnen individuelle Beratung und Unterstützung.
Qualitätsmanagementsysteme für Hersteller (ISO 13485)
Umsetzung der Medizinprodukte-verordnung (MDR)
Risikomanagement für Medizinprodukte
(ISO 14971)
Programmierbare Elektrische Medizinische Systeme (PEMS)
Softwarelebenszyklus
(IEC 62304)
Gebrauchstauglichkeitsorientierter Entwicklungsprozess
(IEC 62366-1)
Elektrische Sicherheit von medizintechnischen Geräten
(ISO 60601-1)
Technische Dokumentation für Medizinprodukte nach normativen Anforderungen
Dienstleistungen
Die folgenden Dienstleistungen können wir für Sie übernehmen.

Audit-Service
Wir führen für Sie die geforderten internen System-Audits (nach ISO 13485) durch.

PRRC-Service
Wir übernehmen für Ihr Unternehmen die Aufgaben der verantwortlichen Person nach Art. 15, sofern es sich um ein Kleinst- oder Kleinunternehmen im Sinne der Empfehlung nach 2003/361/EG handelt.

EU-Rep-Service
Wir übernehmen das Mandat als Bevollmächtigter nach Art. 11. und stellen die Schnittstelle zwischen Ihnen und den Behörden dar, sofern Sie Ihren Sitz außerhalb der EU haben.

Einführungs-Service
Wir unterstützen Sie bei der Einführung eines QMS nach ISO 13485 und begleiten Sie bis zur Zertifikatserteilung.
Unsere Schulungen für Sie im Angebot
Absolvieren Sie alle vier Kurse und erhalten Sie nach erfolgreicher Prüfung ihr eigenes Zertifikat zum Manager Regulatory Affairs.
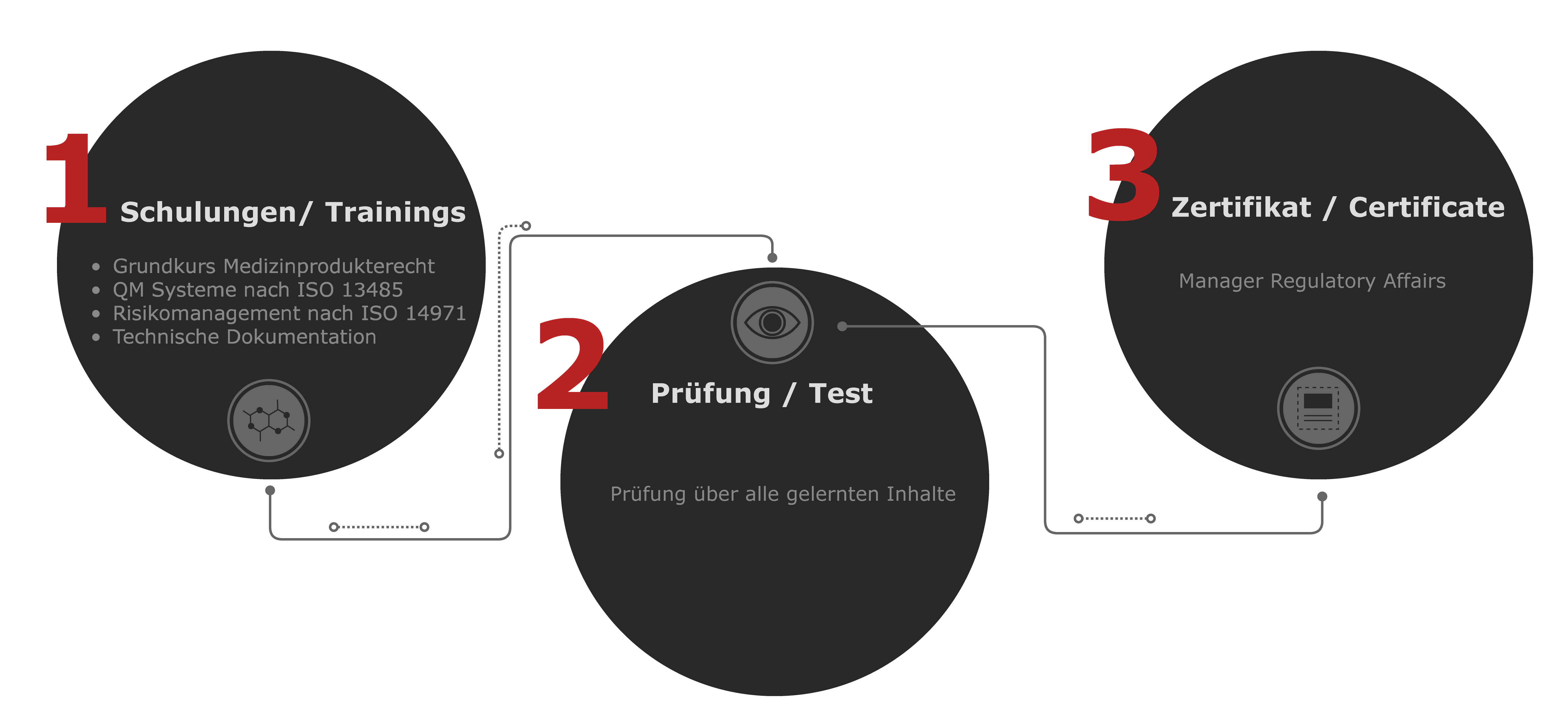
Grundkurs Medizinprodukterecht MDR
€ 490
/ 1 Tag
- Aktueller Gesetzesrahmen für Medizinprodukte in Europa (MDR, 2017/745)
- Klassifizierung von Medizinprodukten, Konformitätsbewertungs-verfahren, CE-Kennzeichnung
- Grundlegende Sicherheits- und Leistungsanforderungen
Qualitätsmanagement-systeme für Hersteller nach ISO 13485
€ 490
/ 1 Tag
- Struktur, Inhalte und Anwendung der ISO 13485:2016
- Vertiefung ausgewählter Kernprozesse
Risikomanagement für Medizinprodukte nach ISO 14971
€ 690
/ 2 Tage
- Anforderungen der ISO 14971 und deren Umsetzung
- Risikomanagementplan, Risikoanalyse, Risikobewertung
- Praxisorientierter Umsetzungsworkshop
Technische Dokumentation für Medizinprodukte
€ 490
/ 1 Tag
- Anforderungen, Inhalte Technische Dokumentation
- Bedeutung für Konformitäts-bewertungsverfahren, Benannte Stellen und Behörden
- Grundlagen klinische Bewertung
- Grundlagen Post-Market-Surveillance
Häufig gestellte Fragen
Ja! Damit ein Kurs stattfinden kann müssen mindestens fünf Teilnehmer pro Kurs angemeldet sein.
Die Schulungen können als Inhouse Schulungen sowohl online oder in Präsenz stattfinden, wenn die Hygienemaßnahmen dies absichern.
Eine Inhouse Schulung ist ein Instrument der betrieblichen Weiterbildung im Kontext der Personalentwicklung. Die Mitarbeitenden erhalten einen maßgeschneiderten firmeninternen Kurs durch unsere BeraterInnen.
Die Schulungen werden von unseren BeraterInnen gehalten.

